 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 97 篇 doi: 10.5376/mpb.cn.2011.09.0097
收稿日期: 2011年07月21日 接受日期: 2011年08月08日 发表日期: 2011年08月17日
引用格式(中文):
王爱香等, 2011, 火鹤胚状体诱导与发生过程中愈伤组织细胞学观察, 分子植物育种(online) Vol.9 No.97 pp.1700-1705 (doi: 10.5376/mpb.cn.2011.09.0097)
引用格式(英文):
Wang et al., 2011, Histocytology Observation on Anthurium andraeanum Callus during Embryoid Induction Stage and Development Stage, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.97 pp. 1700-1705 (doi: 10.5376/mpb.cn.2011.09.0097)
本研究以火鹤"阿拉巴玛"幼嫩叶片为材料,采用石蜡切片技术对其胚状体诱导和发生过程中愈伤组织进行了细胞学观察。结果表明:叶片在1/2MS+0.6 mg/L 2,4-D+0.5~1.0 mg/L 6-BA以及1/2MS+0.4 mg/L 2,4-D+1.0 mg/L 6-BA培养基中获得了较高的愈伤诱导率;该愈伤组织表面光滑、紧实,显微观察可见有许多愈伤组织结节和芽原基的分布,未观察到胚状体发生;上述愈伤组织转至1/2MS+1.0 mg/L 6-BA+0.1 mg/L KT+0.5 mg/L NAA的培养基中进行继代培养,愈伤组织表面形成不定芽,并在原愈伤组织切块边缘形成新愈伤组织。新愈伤组织黄绿色、表面不光滑、质地疏松。显微观察显示:在新愈伤组织表面及内部均有胚状体的发生,一些多细胞原胚与周围愈伤组织产生明显的界限,在一些多细胞原胚表面又形成新的原胚分化中心,愈伤组织中的体细胞胚发生呈现不同步性和多样性。
火鹤(Anthurium andraeanum)组培苗生产可通过不定芽发生途径及胚状体发生途径两种方式(Beyramizade et al., 2008)。相对于前者,胚状体发生途径有如下优点:体细胞胚再生的植株多数情况起源于单个胚性细胞,不会出现遗传嵌合、遗传突变等缺点;若结合液体悬浮培养或生物反应器,繁殖数量多,速度快,结构完整;重现胚胎发生途径,生理年龄较小,再生苗质量更高;再生系统遗传上稳定、再生频率高,是理想的遗传转化系统(沈海龙, 编著, 2003, 植物组织培养, 中国林业出版社, pp.109)。因此,研究火鹤胚状体诱导与发生对于火鹤商品化种苗生产及构建遗传转化系统具有重要价值。目前,国内外有一些关于火鹤胚状体诱导与成苗的研究报道。最早Kuenule以火鹤叶片为外植体,采用较低浓度的2,4-D与BA,观察到了疑似胚性愈伤组织的形成,并从该愈伤组织再生出小苗,但该小苗是否通过胚状体成苗还不能确定(Kuennle and Sugii, 1991);第2年Kuenule采用较高浓度2,4-D (2~4 mg/L)与KIN配合诱导出胚状体并成苗(Adelheid et al., 1992)。后来的学者主要研究火鹤体细胞胚状体诱导和发生过程中的培养条件的优化。例如,Prakash研究发现Nitsch培养基中添加椰子汁、香蕉汁等天然复合物能促进火鹤胚状体发生(Prakash et al., 2002),辛伟杰研究发现在改良MS培养中添加高浓度2,4-D和较低度BA有利于火鹤体细胞胚状体的诱导(辛伟杰等, 2006),而Beyramizade研究认为改良MS培养中添加高浓度2,4-D和较低度KIN有利于火鹤体细胞胚状体的诱导(Beyramizade et al., 2008)。目前对火鹤胚状体发生的细胞学观察少有人研究。由于不定芽和胚状体发生都要经过一个愈伤组织发生阶段,何种愈伤组织再生不定芽或胚状体,完全凭研究者或生产者经验,缺乏科学性;甚至有人在火鹤组培诱导的愈伤组织中既观察到了不定芽的再生又观察到了胚状体的再生(赵云鹏等, 2005)。因此,开发火鹤体细胞胚状体发生的形态标记(肉眼观察愈伤组织形态结构)、细胞学标记(显微观察胚状体发生)和分子标记(胚性细胞激发和胚状体发育的标记基因等)的关联体系,对于科学指导火鹤胚状体诱导与发生、指导火鹤胚状体种苗生产具有重要意义。本论文主要研究细胞学标记与形态学标记的关联,并以此区别胚状体诱导阶段和发生阶段,有助于了解火鹤胚状体诱导与发育的细胞学机理,并能为后续研究中寻找相关阶段分子标记物提供依据。
1结果与分析
1.1愈伤组织诱导及继代培养结果
接种后2~3 d外植体由平铺变为向上鼓起,切口处变为黑色。接种后20 d少数外植体切口处黑色部位变得不连续。接种后1个月伤口处变为乳白色,叶脉切伤处可见连成片的乳白色愈伤,主脉切口处最为明显。1个半月后愈伤逐渐长大成块,外植体诱导2个月的愈伤组织团为浅黄褐色略带红色,蓇葖状(图1-1)。加有不同浓度激素的培养基中的愈伤诱导率不同,其中A4、A5、A6等3种培养基中获得较高的愈伤诱导率(表1)。
![]()
图1 火鹤胚状体诱导过程中愈伤组织诱导及继代培养
Figure 1 Callus induction and subculture during the Anthurium andraeanum's embryoid induction

表1 不同激素浓度配比对火鹤愈伤组织诱导的结果
Table 1 Effect of different doses of regulators on Anthurium andraeanum callus induction
将上述愈伤组织切割成小块后接种于1/2MS+1.0 mg/L 6-BA+0.1 mg/L KT+0.5 mg/L NAA上继代培养。培养10 d后,愈伤组织增殖,并出现绿色芽点;20 d后,愈伤组织上出现大量红色叶鞘包被的绿色不定芽,较大的愈伤组织块周围长出浅黄色或者黄绿色胚性愈伤(图1-2);1个月后,芽持续生长,胚性愈伤组织也进一步膨大(图1-3)。
1.2启动培养诱导的愈伤组织的细胞学观察
外植体诱导2个月的愈伤组织团为浅黄褐色略带红色,表面比较光滑,紧实(图1-4)。石蜡切片观察显示:其表皮层跟近表皮层有明显的界限(图2-1),表皮细胞大而不规则,近表皮层存在着较多的以薄壁细胞为主体的愈伤组织结节(图2-2),它们是由一团排列紧密、体积比较小、细胞核比较明显的分生性细胞组成,是将来不定芽芽原基分化的基础。在愈伤组织中心,有一团细胞,体积比较小,核占细胞的比例大,核和核仁颜色深,细胞质浓,生长方向背离愈伤组织的中央,排列比较紧密,出现了芽原基的分化(图2-3)。芽原基逐渐长大分化出叶原基并突破表皮愈伤组织(图2-4, 图2-5),最终长成为不定芽(图2-6, 图2-7)。在切片观察时看到愈伤组织内部有大量的错综复杂的管胞集团(图2-8),以及零星散布的草酸钙结晶(图2-9)。启动培养诱导的愈伤组织中未观察到体细胞胚的发生。
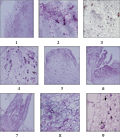
图2 火鹤启动培养获得的愈伤组织细胞学观察
Figure 2 Cytological observation of the induced callus during the Anthurium andraeanum initiation stage
1.3继代培养获得的胚性愈伤组织的细胞学观察
将启动培养获得的愈伤组织切成小块,转入不加2,4-D的培养基上进行继代培养。20~30 d后,愈伤组织上长出不定芽,同时愈伤组织块周围长出浅黄色或者黄绿色胚性愈伤组织。这些愈伤组织表面不光滑、质地疏松(图1-5),继续生长膨大。石蜡切片观察显示,该愈伤组织许多细胞中含有较多的淀粉粒。在一些含淀粉粒的细胞群中,有些细胞成长为胚性细胞:细胞核大、细胞质浓厚、染色较深、发生质壁分离(图3-A)。有的胚性细胞经过分裂形成两个子细胞(图3-B)。有的胚性细胞不断进行分裂,形成由数十个细胞组成的多细胞胚(图3-C)。多细胞胚持续分裂与周围愈伤组织形成明显界限(图3-D)。原胚细胞持续分裂向愈伤组织表层方向生长,其周围的薄壁细胞逐渐解体消失,最后突破愈伤组织表层细胞(图3-E),成为突出于愈伤组织表层的原胚(图3-F)。由内起源产生的原胚表面会附着有部分残留的细胞碎片。有些内起源产生的原胚未能突破愈伤组织表皮细胞就已经长成为心形胚,但这些多细胞原胚都与周围组织细胞有明显界限,原胚周围的薄壁细胞退化或解体(图3-H, 图3-I)。火鹤体细胞胚发生具有多样性,在某些视野中有时可同时观察到几个发育程度不同的多细胞原胚(图3-E, 图3-F, 图3-G);在一些发育成熟的体细胞胚的表面或边缘还可观察到新的多细胞原胚发生中心——次生胚的发源地(图3-D, 图3-I)。
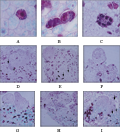
图3 火鹤体细胞胚发生的细胞学观察
Figure 3 Cytological observation of somatic embryogenesis from the new callus
2讨论
关于火鹤离体快繁的途径国内外已有不少报道,但大多停留在器官发生途径的层次上,且主要研究离体快繁条件的优化。Adelheid等首次研究了火鹤离体再生途径,认为器官发生的可能性要大于体细胞胚发生,但品种间有差异(Adelheid et al., 1992)。赵云鹏以较低浓度的2,4-D (0.1 mg/L)诱导叶片获得愈伤组织,愈伤组织转到不加2,4-D的分化培养基中,发现火鹤离体形态发生途径以不定芽发生途径为主、以体细胞胚发生途径为次(赵云鹏等, 2005)。本试验首先在含有较高浓度2,4-D 0.4~0.6 mg/L的培养基中诱导出愈伤组织,然后将上述愈伤组织转到不加2,4-D的培养基中诱导出不定芽和胚性愈伤组织,对上述两种愈伤组织的细胞学结构进行了解剖观察。结果在前一种愈伤组织中,发现了愈伤组织结节和芽原基的分化,这成为继代培养中不定芽的起源;但是在该愈伤组织未发现体细胞胚的发生。在后一种愈伤组织发现了大量的发育不同步的体细胞原胚。2,4-D是诱导植物体细胞转变为胚性细胞的重要激素,其作用是微妙的,一方面诱导胚性愈伤组织必不可少,另一方面其存在会抑制体细胞胚的进一步发育。所以,体细胞间接发生途径分为两个阶段,一是诱导阶段,必须加2,4-D;二是体细胞胚发生阶段,必须降低或去除2,4-D (Zimmerma, 1993)。本研究试验中,启动培养中诱导出的愈伤组织并未观察到任何胚状体的发生,可能与2,4-D抑制胚状体发生有关。但是尽管如此,2,4-D已经赋予上述愈伤组织部分细胞具有成胚能力,将愈伤组织转到不加2,4-D的培养基进行继代培养,新长出的愈伤组织中观察到了大量发育不同步的体细胞胚。
Steward 提出了体细胞发生的细胞隔离学说:体细胞只有从临近的细胞中隔离出来才能表现出胚胎发生倾向(Steward et al., 1958)。在许多植物中可以观察到其体细胞胚在多细胞胚阶段与周围细胞形成明显分界线(Zee and Wu, 1980)。本研究观察到花烛胚性愈伤组织中,单个胚性细胞常发生质壁分离(图3-A),可能胞间连丝丧失造成的隔离促进了体细胞分化。在原胚阶段的中后期,其与周围细胞出现界限,一些原胚周围的细胞甚至退化或解体(图3-H, 图3-I)。
经过2,4-D诱导形成的愈伤组织,会继续分化形成一类液泡小、细胞质浓的小细胞,它们聚集成丛状,被称为胚胎发生丛(embryogenic clump, EC)。EC表面是高度分生化的细胞团,其表面可产生大量的胚状体。EC可以增殖、崩溃而不衰。EC中心细胞的增殖、膨胀使EC崩溃,崩溃后分生性的表面细胞结合成群,又形成新的EC。EC在转入降低或去除生长素、降低还原氮的培养基后,完成胚状体的发育(Steward et al., 1964)。何业华观察到菠萝愈伤组织的内部和表面都有体细胞胚的发生,在同一个视野可以观察到多个体细胞胚发生中心,体细胞胚发生表现出不均匀、不同步,有些胚状体还形成了次生胚(何业华等, 2010)。本研究也观察到花烛胚性愈伤组织有多个发育不同步的体细胞分化中心(图3-E),甚至在一些胚状体表面又形成新的体细胞分化中心(胚胎发生丛) (图3-D, 图3-I),成为次生胚发生的来源。
由上述研究可见,较高浓度2,4-D诱导获得的火鹤初代愈伤组织并没有体细胞原胚的发生;但是继代获得的新的愈伤组织观察到了大量的发育不同步的体细胞原胚发生。这与赵云鹏以较低浓度的2,4-D 0.1 mg/L诱导最后获得大量不定芽及少量体细胞原胚有明显不同(赵云鹏等, 2005)。但是,生产上要想获得整齐的胚状体种苗,还需要在我们研究的基础上,进行液体悬浮培养、低温处理等措施进行体细胞胚发生同步化控制的研究(张宇和沈海龙, 2007)。
3材料与方法
3.1实验材料
火鹤盆栽品种“阿拉巴玛”(Anthurium andraeanum ‘Alabama’)购自于北京五洲翔远农业发展有限公司,以盆栽方式种植于温室中。
3.2实验方法
3.2.1愈伤组织的诱导与继代培养
取刚展开的幼嫩叶片为外植体材料,经过0.1%升汞3 min表面灭菌后,用无菌水冲洗4~5 遍,将叶片沿中脉切成1×1 cm叶片切块平铺接种于(表1)所示的不同培养基中,培养基PH值为5.8,每种培养基接种10瓶,每瓶3块叶片,于(25±2)℃黑暗条件下诱导愈伤组织。两个月后待粒状愈伤组织连成片后,将愈伤组织切割置于1/2MS+1.0 mg/L 6-BA+0.1 mg/L KT+0.5 mg/L NAA上继代培养。
3.2.2愈伤组织的细胞学观察
分别取“阿拉巴玛”叶片在加有2,4-D的培养基上诱导产生的愈伤组织、以及上述愈伤组织分割成小块后在未加2,4-D的继代培养基上新产生的愈伤组织为材料,切成小块,用FAA固定液固定24 h,采用常规石蜡切片法切片,切片厚度8 μm,用番红固绿染色法染色,中性树胶封片,在光学显微镜下观察并拍照。
作者贡献
王爱香和彭娇是本研究的实验设计和实验研究的执行人;王爱香完成数据分析,论文初稿的写作;贾月慧参与实验设计,试验结果分析;张克中是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由北京市教委科技创新平台(PXM2009-014207-078529)和北京市科技新星项目(2003B013)共同资助。作者感谢北京农学院洪培培硕士在本实验过程中的技术帮助和有益的建议。
参考文献
Adelheid R.K., Chen F.C., and Sugii N., 1992, Somatic embryogenesis and plant regeneration in Anthurium andraeanum, Plant Cell Reports, 11(9): 438-442
Beyramizade E.P., Azadi P., and Mii M., 2008, Optimization of factors affecting organogenesis and somatic embryogenesis of Anthuruim andreanum Lind. Tera, Propagation ornamental plants, 8: 198-203
He Y.H., Fang S.Q., Ma J., Hu Z.Y., Lu M., and Hu B., 2010, Histocytology observation on the somatic embryogenesis in ananas comosus callus, Yuanyi Xuebao (Acta Horticulturae Sinica), 37(5): 689-696 (何业华, 方少秋, 马均, 胡中沂, 卢敏, 彭兵, 2010, 菠萝愈伤组织中体细胞胚起源过程的组织细胞学观察, 园艺学报, 37(5): 689-696)
Kuennle A.R., and Sugii N., 1991, Callus induction and plantlet regeneration in tissue culture of Hawaiian Anthuruims, Hortic. Sci., 26(7): 919-921
Prakash D., Angadi M.B., and Shankarmurthy G., 2002, Effect of different adjuvants on in vitro embryo culture of Anthurium andraeanum, J. Ornam. Hort., 5: 67-68
Steward F.C., Mapes M.O., and Mears K., 1958, Growth and organized development of cultured cells. Ⅱ. organization in cultures grown from freely suspended cells, American Journal of Botany, 45(10): 705-708 http://dx.doi.org/10.2307/2439728
Steward F.C., Mapes M.O., Kent A.E., and Holsten R.D., 1964, Growth and development of cultured plant cells, Science, 143(3601): 20-27 http://dx.doi.org/10.1126/science.143.3601.20
Xin WJ., Xu B., Wang GD., Guo W.M., Wen F.D., and Jin J.P., 2006, Somatic embryogenesis and plant regeneration of Anthurium andraeanum, Yuanyi Xuebao (Acta Horticulturae Sinica), 33(6):1281-1286 (辛伟杰, 徐彬, 王广东, 郭维明, 文方德, 金剑平, 2006, 花烛体细胞胚胎发生及植株再生研究, 园艺学报, 33(6): 1281-1286)
Zee S.Y., and Wu S.G., 1980, Somatic embryonenesis in the leaf explants of Chinese celery, Australian Journal of Botany, 28(4): 429-436 http://dx.doi.org/10.1071/BT9800429
Zhang Y., and Shen H.L., 2007, Control of synchronization for plant somatic embryogenesis, Plant Physiology Communications, 43(3): 583-587 (张宇, 沈海龙, 2007, 植物体细胞胚同步化发生的控制, 植物生理学通讯, 43(3): 583-587)
Zhao Y.P., Guo W.M., and Wang G.D., 2005, Observation on Anatomic Structure of Eight Kinds of Calli in Anthurium andraeanum, Yuanyi Xuebao (Acta Horticulturae Sinica), 32(1): 60-64 (赵云鹏, 郭维明, 王广东, 2005, 花烛不同愈伤组织解剖结构的观察, 园艺学报, 32(1): 60-64)
Zimmerma J.L., 1993, Somatic embryogenesis: A model for early development in higher plants, Plant Cell, 5(10): 1411-1423 http://dx.doi.org/10.1105/tpc.5.10.1411 http://dx.doi.org/10.2307/3869792